En un paso prometedor hacia terapias personalizadas más efectivas, científicos del CONICET y la Fundación Instituto Leloir (FIL) desarrollaron un adenovirus oncolítico (AOL) innovador que suprime metástasis hepáticas de cáncer colorrectal en modelos animales. Bautizado AR2015, este virus –derivado de un patógeno común del resfrío y modificado genéticamente– se administra por vía endovenosa y logra erradicar tumores completos cuando se combina con bajas dosis de quimioterapia. Los resultados, publicados en la revista Molecular Therapy: Oncology, abordan uno de los mayores obstáculos en oncología: la heterogeneidad celular que permite a las células malignas resistir tratamientos y provocar recaídas.
“Dentro de un tumor coexisten diferentes tipos de células malignas. Esta diversidad genética favorece la resistencia del cáncer a la respuesta inmune y a los tratamientos antitumorales, y constituye la principal causa de la reaparición del tumor, impulsando su diseminación metastásica”, explicó Osvaldo Podhajcer, investigador principal del CONICET en el Instituto de Investigaciones Bioquímicas de Buenos Aires (IIBBA, CONICET-FIL) y jefe del Laboratorio de Terapia Molecular y Celular (LTMC) de la FIL. Junto a Eduardo Cafferata, también del CONICET en el IIBBA y LTMC, Podhajcer colideró el estudio que valida esta estrategia contra la heterogeneidad tumoral, responsable del fracaso de muchas terapias dirigidas basadas en anticuerpos monoclonales o fármacos específicos.
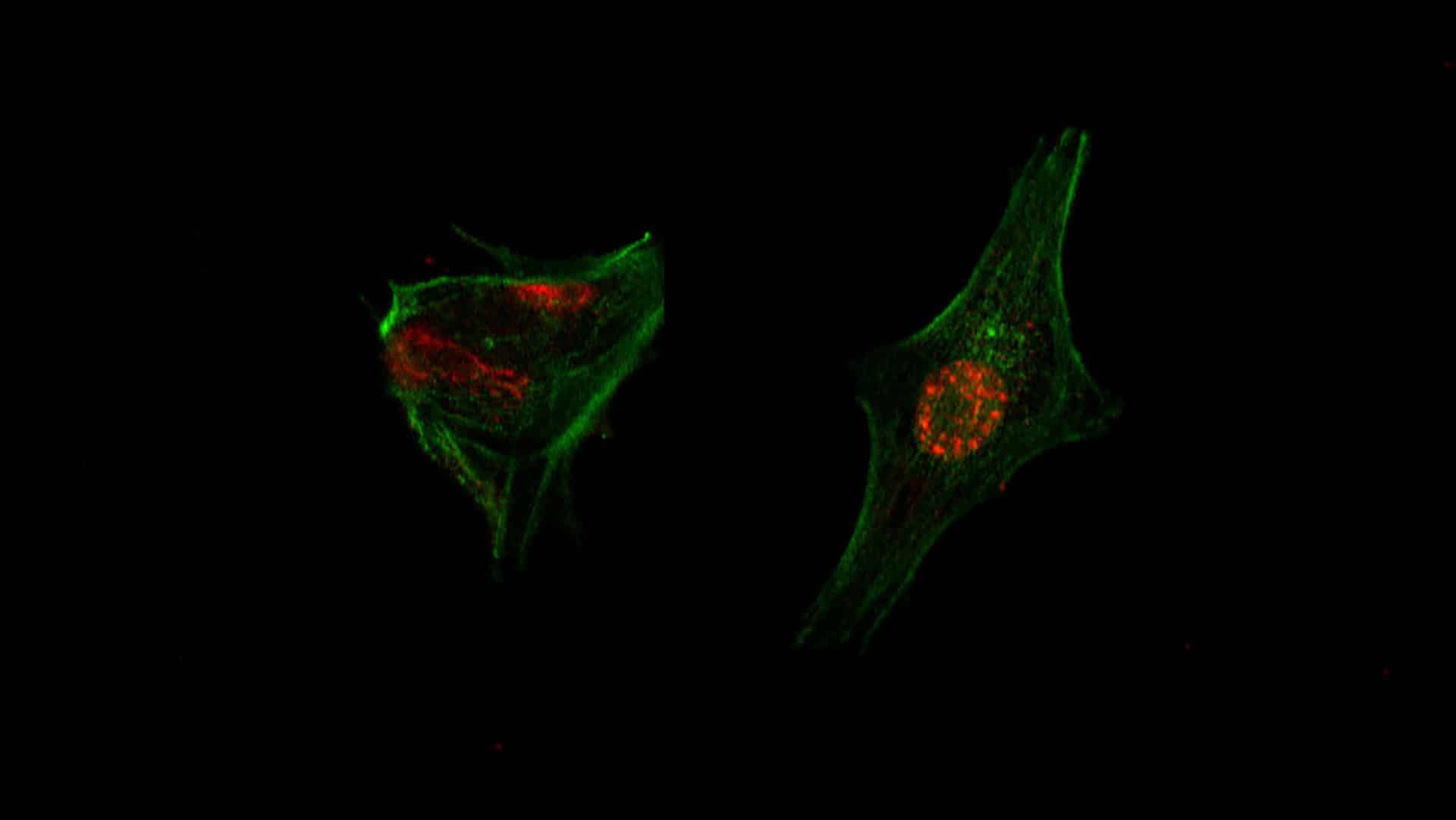
Desde hace más de una década, el equipo de Podhajcer transforma adenovirus causantes de resfríos en herramientas terapéuticas selectivas. En este trabajo, reemplazaron una secuencia nativa del virus por promotores específicos de tumores (TSP) híbridos, creados en laboratorio a partir de genes activos en células cancerosas. AR2015 incorpora un TSP compuesto por fragmentos de los promotores A33 y vWA2, asegurando que el virus se replique exclusivamente en diversas poblaciones malignas hasta destruirlas.
“En el genoma del adenovirus, la proteína E1A regula toda su actividad y multiplicación, lo que lleva a la muerte de las células malignas. Reemplazamos su promotor nativo por un híbrido de dos TSP diferentes”, detalló Cafferata. Análisis previos en muestras de pacientes mostraron que, en todos los tumores primarios y metástasis de cáncer colorrectal examinados, al menos uno de estos genes (A33 o vWA2) está activo, ampliando el espectro de ataque similar a un antibiótico de amplio rango.
En experimentos con ratones, AR2015 suprimió metástasis hepáticas de células humanas de cáncer colorrectal. La combinación con quimioterapia en dosis bajas potenció el efecto, logrando erradicación completa y sostenida en el tiempo. “Hemos mejorado la potencia del AOL manteniendo su especificidad”, enfatizó Podhajcer, quien destacó compatibilidad con inmunoterapias en estudios no publicados.
La elección de A33 y vWA2 no fue casual. Los investigadores analizaron bioinformáticamente dos bases de datos de genes asociados al cáncer colorrectal, seguidas de tres más. De miles de promotores posibles, algoritmos personalizados redujeron la lista a 200, luego 20, seis y finalmente dos. “Esto valida la prueba de concepto de que los AOL pueden atacar la heterogeneidad genética en cáncer”, agregó Podhajcer.
El equipo ya avanza: incorporaron más promotores en TSP híbridos y modificaciones que minimizan escapes tumorales. Aunque enfocado en cáncer colorrectal, Cafferata afirmó que el enfoque podría aplicarse a otros tumores gastrointestinales y, potencialmente, a diversos tipos de cáncer.